(1)某温度下纯水的c(氢离子)=2.0×10的负7次方 mol/L.
来源:学生作业帮 编辑:神马作文网作业帮 分类:化学作业 时间:2024/11/13 00:26:10
(1)某温度下纯水的c(氢离子)=2.0×10的负7次方 mol/L.
在此温度下,某溶液中由水电离出的c(氢离子)为4.0×10的负13次方 mol/L,则该溶液的pH可能是( ). (2).分别将少量CO2气体CO2气体通入一元酸的钠盐NaA和NaB 的溶液中,发生的反应为:(1)CO2+2 NaA+H2O=Na2CO3+2HA;(2)CO2+NaB+H2O=NaHCO3+HB ,试由此推断H2CO3、HCO3负1次方、HA、HB 的电离程度由大到小顺序为 ( ). (3)已知在相同条件下,HCN的电离程度比HF小.请根据有关知识分析判断,在相同温度下,物质的量浓度相同的NaCN 溶液和NaF 溶液中:[c (CN的负1次方) + c(OH的负1次方)]--------------[c (F 的负1次方)+c (OH的负1次方 )](选填:'等于'、‘大于’或‘小于’). 具体怎么填的 .谢谢.为什么?
在此温度下,某溶液中由水电离出的c(氢离子)为4.0×10的负13次方 mol/L,则该溶液的pH可能是( ). (2).分别将少量CO2气体CO2气体通入一元酸的钠盐NaA和NaB 的溶液中,发生的反应为:(1)CO2+2 NaA+H2O=Na2CO3+2HA;(2)CO2+NaB+H2O=NaHCO3+HB ,试由此推断H2CO3、HCO3负1次方、HA、HB 的电离程度由大到小顺序为 ( ). (3)已知在相同条件下,HCN的电离程度比HF小.请根据有关知识分析判断,在相同温度下,物质的量浓度相同的NaCN 溶液和NaF 溶液中:[c (CN的负1次方) + c(OH的负1次方)]--------------[c (F 的负1次方)+c (OH的负1次方 )](选填:'等于'、‘大于’或‘小于’). 具体怎么填的 .谢谢.为什么?
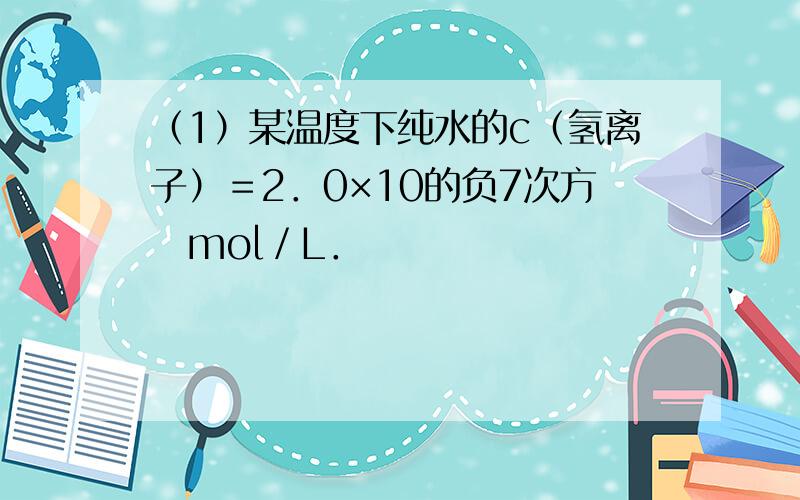
1.某温度下纯水的c(氢离子)=2.0×10的负7次方 mol/L.
所以水的离子积常数Ksp=4.0X10^-14
在此温度下,某溶液中由水电离出的c(氢离子)为4.0×10的负13次方 mol/L,则该溶液可以是酸或碱,可果是碱,其PH=-lg4.0X10^-13=12.4;如果是碱,其PH=13.4-12.4=1
2.根据强酸生成弱酸:H2CO3、HB、HCO3-、 HA
3.根据物料平衡,
c(Na+)=c(CN-)+c(HCN)
c(Na+)=c(F-)+c(HF)
溶液中HCN和HF来源的水解,它们的浓度与溶液的OH-浓度相向,
所以
c(CN-)+c(HCN) =c(F-)+c(HF)
所以水的离子积常数Ksp=4.0X10^-14
在此温度下,某溶液中由水电离出的c(氢离子)为4.0×10的负13次方 mol/L,则该溶液可以是酸或碱,可果是碱,其PH=-lg4.0X10^-13=12.4;如果是碱,其PH=13.4-12.4=1
2.根据强酸生成弱酸:H2CO3、HB、HCO3-、 HA
3.根据物料平衡,
c(Na+)=c(CN-)+c(HCN)
c(Na+)=c(F-)+c(HF)
溶液中HCN和HF来源的水解,它们的浓度与溶液的OH-浓度相向,
所以
c(CN-)+c(HCN) =c(F-)+c(HF)
(1)某温度下纯水的c(氢离子)=2.0×10的负7次方 mol/L.
某温度时,纯水中【H+】=2乘于10负7次方mol·L负1次方,此温度下0.01mol`L负1的NaOH溶液的PH应为?
某温度下纯水的C(H+)=2.0X10负七次方mol/L.在此温度下
某温度下,纯水中的氢离子浓度约为10的负6次方摩尔每升,求C(OH-)
在某温度时,测得纯水中的氢离子浓度为2.4×10的-7次方mol/l,则氢氧根浓度
某温度,纯水中C(H+)为2×10(-7)次方mol/L,加入稀H2SO4 C(H+)变为5×10(-5)次方mol/L
某温度下纯水的c(H+)=2*10-7mol/L.在此温度下,某溶液中由水电离出的c(H+)为4*10-13mol/L,
7.若一杯纯水中氢离子浓度为(1/2)+10的负7次mol/L.则氢氧根离子浓度为( )
常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10的负8次方 水电离出的c(氢离子)=1*
某温度下,纯水的c(H+)=2.0×10-7 mol/L,则此时c(OH-)为______,KW=______
某温度下纯水的c(H + )=2.0×10 -7 mol·L -1 ,在此温度下,某 溶液中由水电离
某温度下,纯水中的c(H+)=2.0×10-7mol·L-1