0.1mol/L的NaOH溶液0.2L,通入448mL(标况下)H2S气体,所得溶液微粒浓度大小关系正确的是( )
来源:学生作业帮 编辑:神马作文网作业帮 分类:化学作业 时间:2024/11/12 20:36:11
0.1mol/L的NaOH溶液0.2L,通入448mL(标况下)H2S气体,所得溶液微粒浓度大小关系正确的是( )
A. c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+)
B. c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
C. c(Na+)=c(H2S)+c(HS-)+c(S2-)+c(OH-)
D. c(S2-)+c(OH-)=c(H+)+c(H2S)
A. c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+)
B. c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
C. c(Na+)=c(H2S)+c(HS-)+c(S2-)+c(OH-)
D. c(S2-)+c(OH-)=c(H+)+c(H2S)
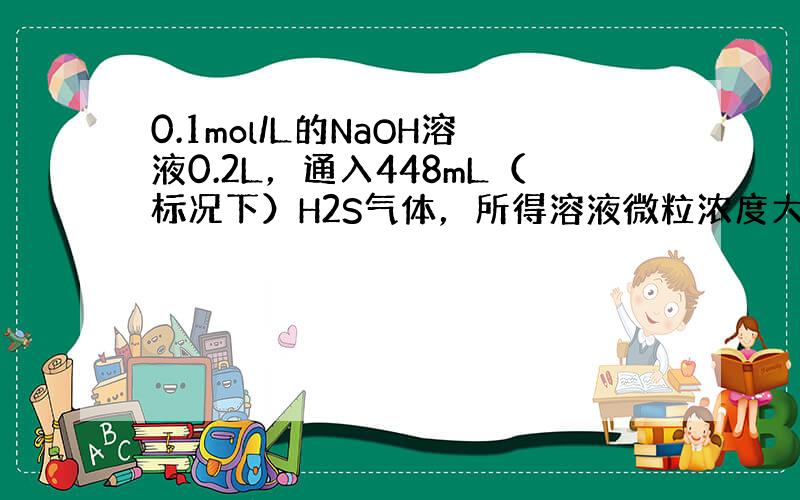
n(NaOH)=0.1mol/L×0.2L=0.02mol,n(H2S)=
0.448L
22.4L/mol=0.02mol,等物质的量的氢氧化钠和硫化氢恰好反应生成NaHS,硫氢化钠是强碱弱酸酸式盐,硫氢根离子易水解而使其溶液呈碱性,
A.NaHS溶液中,HS-和水都电离出氢离子,只有HS-电离出硫离子,所以c(H+)>c(S2-),故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),故B错误;
C.根据物料守恒得c(Na+)=c(H2S)+c(HS-)+c(S2-),故C错误;
D.溶液中存在电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),根据物料守恒得c(Na+)=c(H2S)+c(HS-)+c(S2-),所以得c(S2-)+c(OH-)=c(H+)+c(H2S),故D正确;
故选D.
再问: 能分析下A吗?
0.448L
22.4L/mol=0.02mol,等物质的量的氢氧化钠和硫化氢恰好反应生成NaHS,硫氢化钠是强碱弱酸酸式盐,硫氢根离子易水解而使其溶液呈碱性,
A.NaHS溶液中,HS-和水都电离出氢离子,只有HS-电离出硫离子,所以c(H+)>c(S2-),故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),故B错误;
C.根据物料守恒得c(Na+)=c(H2S)+c(HS-)+c(S2-),故C错误;
D.溶液中存在电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),根据物料守恒得c(Na+)=c(H2S)+c(HS-)+c(S2-),所以得c(S2-)+c(OH-)=c(H+)+c(H2S),故D正确;
故选D.
再问: 能分析下A吗?
0.1mol/L的NaOH溶液0.2L,通入448mL(标况下)H2S气体,所得溶液微粒浓度大小关系正确的是( )
0.1moL/L的NaOH溶液0.2L,通入448mL(标准状况)H2S气体,c(OH-)+ c(S2-)= c(H+)
在0.1mol/L H2S中加入同体积、同浓度的NaOH溶液,反应后溶液中各微粒的浓度关系错误的是
将5ml 0.2mol/l HAC溶液与10ml 0.1mol/l KOH溶液相混合,所得溶液中微粒浓度相对大小顺序是(
将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合,所得混合溶液呈碱性,下列关系正确的是( )
向3mol/L 的NaOH 溶液100ml中缓缓通入4.48L(标况)二氧化碳气体,充分反应后,溶液中离子浓度由大到小排
1.10ml 0.1mol/L CH3COOH溶液与10mL PH=13的NaOH溶液混合,各种微粒浓度大小是?
0.1mol/L弱酸HA溶液与0.05mol/L NaOH溶液等体积混合后所得溶液微粒浓度间的关系有:
标准状况下,将1.12L CO2通入 100mL 1mol/L的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是?
将0.2mol/L CH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列微粒的物质的量浓度关系正确的是( )
常温下,0.1mol/L Na2CO3溶液中各微粒浓度关系正确的是( )
表示0.1mol/L的碳酸氢钠溶液中有关微粒浓度的关系正确的是