反应2KMNO4+16HCL(浓)=2KCL+2MNCL2+8H2O+5CL2中,若生成71gCl2,则转移的电子的物质
来源:学生作业帮 编辑:神马作文网作业帮 分类:化学作业 时间:2024/11/11 20:14:18
反应2KMNO4+16HCL(浓)=2KCL+2MNCL2+8H2O+5CL2中,若生成71gCl2,则转移的电子的物质的量是多少.
搞不懂转移电子的物质是什么,就更别提它的量了.
搞不懂转移电子的物质是什么,就更别提它的量了.
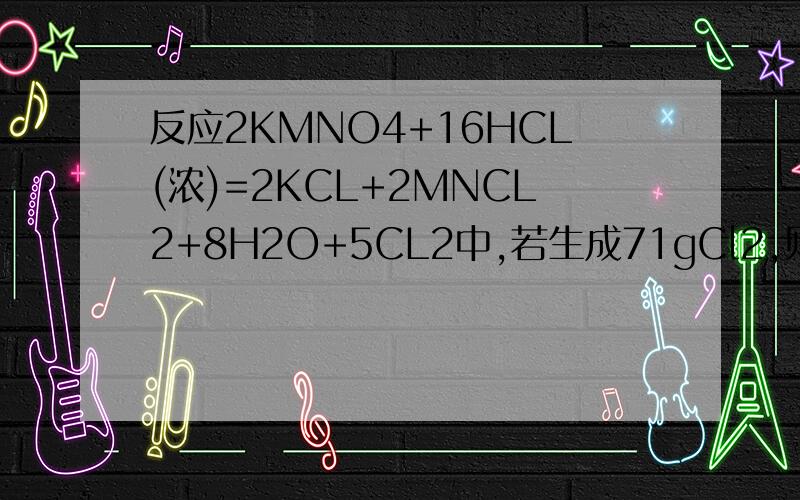
2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2
Mn化合价降低,由+7到+2,降低5价,有2个Mn原子变化,
所以2 mol KMnO4共得到10e-
Cl化合价升高,由-1到0,降低1价,有10个Cl变化,有6个Cl不变,进入KCl、MnCl2中.
16 mol HCl共失去10e-
所以转移电子数10e- 5Cl2
· x 1 mol
x= 2 mol
转移电子2 mol
再问: 转移的电子的物质是什么啊。。。是HCL还是KMNO4?
再答: 所谓转移电子,就是还原剂失去电子,给了氧化剂。 所以HCl失去电子,给了KMnO4。 你理解错了
再问: 那书上题目是这样写的啊,难道它写错了,应该是转移电子的量?
再答: 书上没错。 转移电子数,就是“氧化剂得到的电子数”或者“还原剂失去的电子数”
再问: 哦,知道了,谢谢
Mn化合价降低,由+7到+2,降低5价,有2个Mn原子变化,
所以2 mol KMnO4共得到10e-
Cl化合价升高,由-1到0,降低1价,有10个Cl变化,有6个Cl不变,进入KCl、MnCl2中.
16 mol HCl共失去10e-
所以转移电子数10e- 5Cl2
· x 1 mol
x= 2 mol
转移电子2 mol
再问: 转移的电子的物质是什么啊。。。是HCL还是KMNO4?
再答: 所谓转移电子,就是还原剂失去电子,给了氧化剂。 所以HCl失去电子,给了KMnO4。 你理解错了
再问: 那书上题目是这样写的啊,难道它写错了,应该是转移电子的量?
再答: 书上没错。 转移电子数,就是“氧化剂得到的电子数”或者“还原剂失去的电子数”
再问: 哦,知道了,谢谢
反应2KMNO4+16HCL(浓)=2KCL+2MNCL2+8H2O+5CL2中,若生成71gCl2,则转移的电子的物质
反应 2KMnO4+16HCl=2KCl+2mNcl2+5Cl2+8H2O 中
实验室也常用下式制取Cl2:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应中氧化剂与
已知反应2KMnO4+16HCl(浓)===2KCl=2MnCl2+5Cl2↑+8H2O,若有71克Cl2生成,求被氧化
有关2kmno4+16hcl=2kcl+2mncl2+5cl2^+8h2o的题,判断正误.
急·````1 2KMnO4+16HCL=2KCL+2MNCL2+5CL2+8H2O向400mL4mol/L的浓盐酸中加
MnO2 + 4HCl(浓)=MnCl2 + Cl2 + 2H2O 反应中当被氧化的HCL为6摩尔时 转移的电子的物质的
实验室制备氯气时:2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2+8H2O 这个反应中,为什么做还原
2kMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O
对反应2KMnO4+16HCL=2KCL+2MnCL2+5CL2↑+8H2O 完成下列问题
在反应MnO2+4HCl=MnCl2+Cl2+2H2O中 当有0.5mol的Cl2生成时,反应中转移的电子数是
在反应MnO2+4HCl=MnCl2+Cl2+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2.试求