0.1mol/L NH4Cl与0.05mol/L NaOH等体积混合,请解释一下其中各种离子浓度大小比较
来源:学生作业帮 编辑:神马作文网作业帮 分类:化学作业 时间:2024/11/23 23:14:20
0.1mol/L NH4Cl与0.05mol/L NaOH等体积混合,请解释一下其中各种离子浓度大小比较
为什么不是CL->NA+>NH4+>H+>OH-
为什么不是CL->NA+>NH4+>H+>OH-
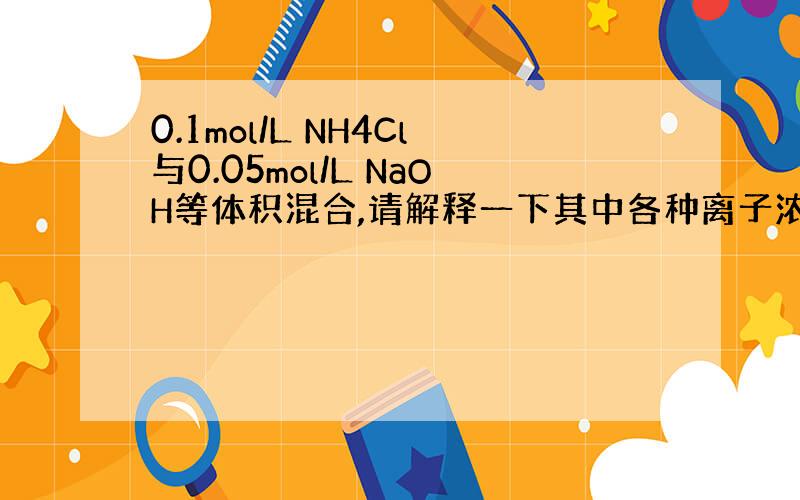
假设各为1L
不考虑水解反应前,溶液中含0.1molNH4+、Cl-,0.05molNa+、OH-
发生反应NH4+ + OH- == NH3+H2O后,含0.05molNH4+、NH3、Na+,1molCl-
其中NH4+少量水解使溶液呈酸性,所以Cl->Na>NH4+>>H+>OH-
“>>”表示远大于,溶液中H+浓度比NH4+浓度小了好几个数量级,故最好用“>>”
不过单从排序上来看Cl->Na+>NH4+>H+>OH-
不考虑水解反应前,溶液中含0.1molNH4+、Cl-,0.05molNa+、OH-
发生反应NH4+ + OH- == NH3+H2O后,含0.05molNH4+、NH3、Na+,1molCl-
其中NH4+少量水解使溶液呈酸性,所以Cl->Na>NH4+>>H+>OH-
“>>”表示远大于,溶液中H+浓度比NH4+浓度小了好几个数量级,故最好用“>>”
不过单从排序上来看Cl->Na+>NH4+>H+>OH-
0.1mol/L NH4Cl与0.05mol/L NaOH等体积混合,请解释一下其中各种离子浓度大小比较
0.1mol/L NH4Cl与0.05mol/L NaOH等体积混合所得的溶液中各种离子浓度大小如何
0.1mol/l的NH4CL溶液与0.05mol/l的NaOH溶液等体积混合,各种微粒浓度大小的比较
0.2mol/l 的 NH4CL溶液 与 0.1mol/l 的NAoH等体积混合 求溶液中各个离子浓度大小
0.1MOL/L的氢氧化钠与0.1mol/l的NH4CL溶液等体积混合离子浓度的大小,
0.01mol/l的NH4CL溶液与0.01mol/l的naoh溶液等体积混合,离子浓度大小关系,为什么、
0.1mol/L NaOH与0.1mol/L NH4CL等体积混合,溶液中离子排序(Na CI OH H)
0.2mol/L的HCN和0.1mol/L的NAOH 等体积混合 问溶液离子浓度比较
0.2mol/L的CH3COOH和0.1mol/L的NaOH的溶液等体积混合呈碱性 则混合液离子浓度大小比较
0.1mol/LNH4CL与0.05mol/L的NaOH等体积混合,溶液中的离子浓度是?
0.01mol/L的CH3COOH和0.01mol/L的NaOH等体积混合,物料守恒方程式怎么写?离子浓度大小比较?
比较离子浓度大小向0.1mol/L NaOH 中加入0.1mol/L NH4Cl 溶液,离子浓度的大小顺序是______