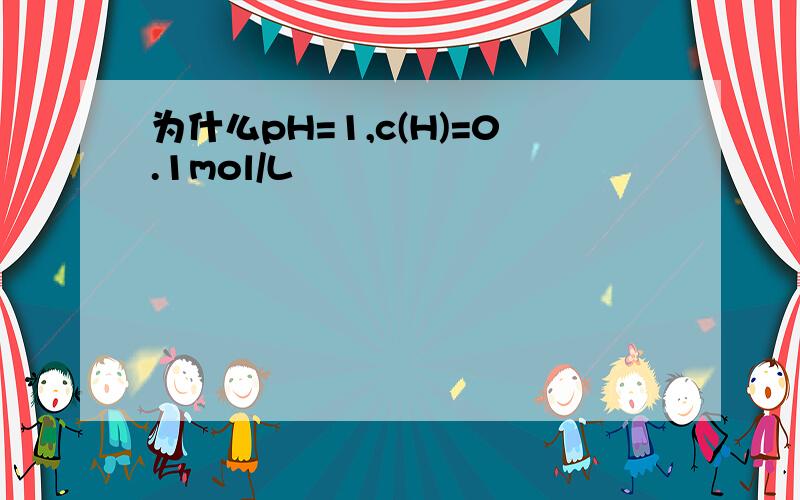
为什么pH=1,c(H)=0.1mol/L
c[H+] = 0.1mol/L ph值=1
为什么水电离出的c(H+)=1×10^(-12)mol/L,则pH=2 or 12
为什么PH=1,c(H+)就等于0.1mol每升
pH=13的NaOH溶液和C(H+)=1mol/L哪个水电离度小
某温度下纯水中C(H+) = 2×10-7 mol/L,0.9mol/L氢氧化钠与0.1mol/L盐酸混合后溶液pH为多
常温时,0.1mol/LHA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,
某温度吓,纯水的c(H+)=1.0x10-6次方mol•L-1次方,此时c(OH-)为什么?PH是多少.呈什
已知0.1mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中c(H+)_0.11mol/L,HB-﹦H+﹢
A、pH=2的溶液中c(H + )=0.01mol/L;pH=1的硝酸溶液中c(H +
常温下,0.1mol/L的Hcl溶液中,c(H+)=?,pH=?,0.05mol/L的Ba(OH)2溶液中,c(OH-)
为什么pH=13的NaOH溶液,c(OH-)=0.1mol/L
C(OH-)=1×10^-5 mol/L ,ph=