FeS2+ HNO3= Fe(NO3)3+ SO2+ NO+ H2O
来源:学生作业帮助网 编辑:作业帮 时间:2024/11/17 05:12:22
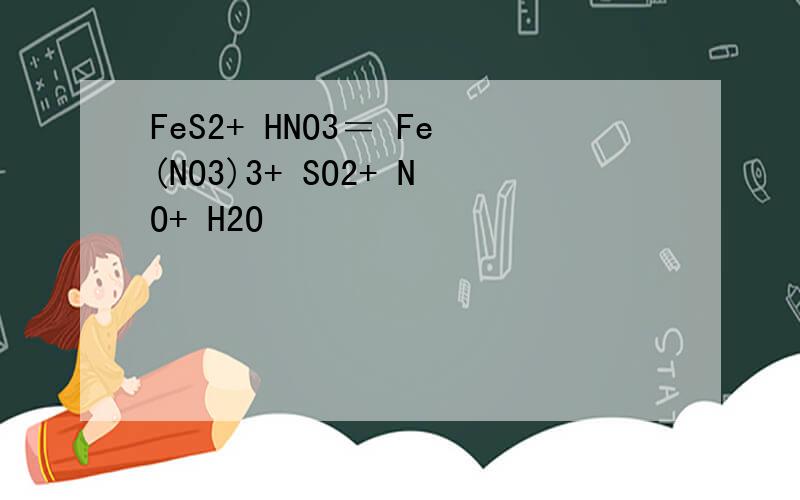
硫化亚铁Fe在初中内容中只有+3和+2和0价.不可能有其他的了.S在其实也有-1价的.只不过初中不做重点说S的-1价,初中只说246价.问题的回答就是Fe是+2价
FeS2与HNO3反应后的产物有Fe(NO3)3和H2SO4,若反应中FeS2与HNO3的分子FeS2+HNO3=Fe(NO3)3+H2SO4+?反应中,硝酸起两个作用,酸的作用和氧化
如下:3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O其实你根据氧化还原配平就行,Fe升高了2,N降低了3,则Fe2+跟NO肯定是3:2啊还有什么不会的可以继续问我
铁足量先于浓硝酸反应而后在与稀硝酸反应因为铁石足量的吗?这句话是错误的.铁足量是铁与正三价的铁离子反应,而不是稀硝酸.稀硝酸是可以吧铁氧化成正三价的.再问:蒽!3Fe+8HNO3=3Fe(NO3)2+
参加反应的硝酸的物质量是3Fe(NO3)2=8摩尔.被还原的硝酸是2摩尔.应该你是对的.参加反应的硝酸是全部的.不会是指于铁反应的6molHNO3.
正2
方程式写错了,应该是6HNO3+Fe(OH)2=Fe(NO3)3+3NO+4H2O
1.3Fe3O4+28HNO3→9Fe(NO3)3+NO↑+14H2O2.没见过NH4NO4(后面的N是+7价吗?)5NH4NO3→4N2↑+2HNO3+9H2O3.Cu2S+14HNO3→H2SO4
答:每1molFe失去3mol电子,每4molHNO3里只有1molHNO3得到3mol电子.
第一个方程式是因为Fe过量,HNO3不足第二个方程式是因为HNO3过量,Fe不足所以化学方程式不一样.
FeS2+HNO3=Fe(NO3)3+H2SO4+?反应中,硝酸起两个作用,酸的作用和氧化剂的作用.与1molFeS2反应生成1molFe(NO3)3,酸的作用的硝酸3mol,则氧化剂作用的有5mol
浓硝酸,不加热,钝化浓硝酸,加热,不钝化,反应得到NO2稀硝酸,无论是否加热,都不钝化,得到NOFe+HNO3(稀,过量)=Fe(NO3)3+NO+H2OFe+4HNO3(浓,过量)==△==Fe(N
你方程式写错了.正确的方程如下:3FeO+10HNO3(稀)=3Fe(NO3)3+5H2O+NO↑
3Fe(OH)2+10HNO3(稀)→3Fe(NO3)3+NO+8H2OFe2O3+6HNO3(稀)→2Fe(NO3)3+3H2O3FeO+10HNO3(稀)→3Fe(NO3)3+NO+5H2O
FeS+6HNO3=Fe(NO3)3+H2SO4+3NO+2H2O
可以把三个铁合在一起算共+8+5共+9+2Fe3O4+HNO3--3Fe(NO3)3+NO+H2O升1降33Fe3O4+28HNO3=9Fe(NO3)3+NO+14H2O
第2问楼上已经回答了.补充一下第一问.FeS2+HNO3=Fe(NO3)3+H2SO4+?反应中,硝酸起两个作用,酸的作用和氧化剂的作用.与1molFeS2反应生成1molFe(NO3)3,酸的作用的
Fe(NO3)2+HNO3--Fe(NO3)3+NO+H2OFe(NO3)2中的Fe是+2价,反应后生成Fe(NO3)3中+3价的Fe,化合价升高1HNO3中的N是+5价,反应后生成NO中+2价的N,
no和no2有没有比例要求,如果没有,你可以先假设no和no2的比例,然后再配平就行了.下面是1:1和1:2的配平系数4:18:4:3:3:95:24:5:3:6:12
3Fe3C+40HNO3=3CO2+13NO+9Fe(NO3)3+20H2O对于这种不知道Fe3C中不同元素的具体化合价时,可设这两种元素的化合价均为零,即用零价配平法来配这类方程.